

Resumo
(Orchidaceae das Serras Negra e do Funil, Rio Preto, Minas Gerais, e similaridade
florística entre formações campestres
e florestais do Brasil). Neste estudo, foi realizado o levantamento das Orchidaceae
das Serras Negra e do Funil (SN/ SF), Zona da Mata de Minas Gerais, e uma análise
da similaridade florística dessa família entre 29 áreas
campestres e florestais do Brasil. Para tal análise, utilizou-se o algoritmo
UPGMA, coeficiente de Sørensen, e 5.000 replicações de
bootstrap. A análise de agrupamento revelou baixos índices de
similaridade, exceto para os grupos Serra Negra + Parque Estadual do Ibitipoca
e Parque Estadual da Ilha do Cardoso + Estação Ecológica
Juréia-Itatins. Os resultados sugerem que a região das SN/SF represente
um corredor florístico entre localidades na Serra da Mantiqueira (Parque
Nacional do Itatiaia) e Serra do Mar (Reserva Biológica de Macaé
de Cima). Foi observado o agrupamento de áreas com semelhanças
ambientais e as regiões de campos rupestres se destacaram em termos de
particularidades florísticas. O teste de Mantel revelou que a similaridade
florística não está correlacionada à distância
geográfica entre as áreas.
Palavras-chave: Biodiversidade, campos rupestres, conservação,
riqueza específica, teste de Mantel
Introdução
Orchidaceae Juss. é uma das maiores famílias de angiospermas,
compreendendo aproximadamente 800 gêneros e 20.000 espécies (Dressler
1993). Possui ampla distribuição geográfica, estando ausente
apenas nos pólos e nas regiões desérticas (Pabst &
Dungs 1975; Dressler 1993; Smith et al. 2004). Alguns de seus gêneros
podem ter distribuição pantropical, mas existem centenas de espécies
com diferentes graus de endemismo (Dressler 1993).
Apesar da representatividade da família, no que tange à riqueza
de espécies, em especial no Brasil, são poucos os estudos especificamente
destinados a avaliar as relações florísticas da família
entre diferentes áreas (vide Fraga & Peixoto 2004; Azevedo &
vand den Berg 2007; Barbero 2007). Hoje, a maioria dos trabalhos que visam o
conhecimento da ecologia e distribuição geográfica da flora
é destinada ao componente arbóreo-arbustivo (p. ex., Oliveira-Filho
& Fontes 2000; Scudeller et al. 2001; Phillips et al. 2003; Reis et al.
2007). Além disso, as pesquisas em ecologia e geografia são feitas
em pequena escala e em um número limitado de localidades (Phillips et
al. 2003). Assim, a relação entre a composição e
a distribuição espacial da flora e seus fatores causais ainda
não são bem entendidos para as florestas tropicais (Phillips et
al. 2003; Tuomisto et al. 2003).
Muitos autores consideram que a distância geográfica é
uma das variáveis mais importantes na distribuição geográfica
das espécies vegetais (Scudeller et al. 2001; Condit et al. 2002). A
similaridade florística entre áreas distintas decresce com o aumento
da distância geográfica entre elas, devido aos limites de dispersão
das espécies (Hubbell et al. 1999). No entanto, outros fatores mostram-se
relevantes no arranjo espacial das espécies vegetais, como o clima, características
edáficas, sazonalidade e precipitação (Clark et al. 1999;
Oliveira-Filho & Fontes 2000; Scudeller et al. 2001; Phillips et al. 2003).
Nesta complexa relação, ainda são incluídos a eficiência
na dispersão, a germinação, e o estabelecimento da planta
(Hensen & Müller 1997), além de fatores mais difíceis
de mensurar como a pressão antrópica, as relações
de competição no habitat e a própria sobrevivência
das plântulas (Clark et al. 1999). Neste contexto, análises estatísticas
representam ferramentas poderosas, pois são capazes de sumarizar conjuntos
de dados amplos e complexos na avaliação objetiva desses problemas
(Pereira 1993). Os métodos estatísticos de classificação
estão relacionados essencialmente ao problema qualitativo da composição
de espécies das comunidades de plantas (Mueller-Dombois & Ellenberg
1974). Semelhantes à ordenação, técnicas de classificação
são destinadas a ajudar o pesquisador a explorar dados e hipóteses
gerais. No entanto, as técnicas de ordenação retratam uma
representação dos dados, e podem ou não mostrar evidências
de agrupamento. Em contraste, as técnicas de classificação
são utilizadas quando o objetivo do trabalho é agrupar objetos,
com base em seus atributos, dentro de classes identificáveis e interpretáveis
que podem ser distinguidas das classes vizinhas (Shaw 2003; Gotelli & Ellison
2004). A técnica de classificação mais amplamente utilizada
é a análise de agrupamento (ou análise de similaridade),
a qual quantifica as distâncias entre unidades amostrais, e as alojam
em um mesmo agrupamento, quando suas distâncias são consideradas
próximas o suficiente (Fowler et al. 1998).
Este estudo teve como objetivos: apresentar o inventário da família
Orchidaceae nas Serras Negra e do Funil, município de Rio Preto, Minas
Gerais, e investigar suas relações florísticas com outras
28 localidades, com fisionomias campestres e/ou florestais no Brasil, com base
no compartilhamento de espécies desta família. Pretende-se com
isso agregar informações que possam auxiliar na classifi cação
da fisionomia campestre encontrada na área de estudo.
Material e métodos
Serras Negra e do Funil (SN/SF)
As Serras Negra e do Funil localizam-se na Zona da Mata de Minas Gerais, entre
os municípios de Lima Duarte, Olaria, Rio Preto e Santa Bárbara
do Monte Verde, a 19 quilômetros do centro de Rio Preto, adjacente à
APA da Mantiqueira. A área de abrangência deste estudo compreende
três regiões cujo acesso é possível através
do Vilarejo do Funil, município de Rio Preto, a saber: a vertente sul
da Serra Negra, o Serrote de Santa Clara e o Serrote de São Gabriel,
os dois últimos, em conjunto, conhecidos na região como Serra
do Funil.
A vegetação dessas serras é caracterizada por um mosaico
composto por formações campestres e florestais. Entretanto, existem
poucos trabalhos sobre a região, e apenas as formações
arbóreas foram estudadas. Valente (2007) enquadrou os fragmentos florestais
em Floresta Ombrófila Densa Alto-Montana e Baixo-Montana e Floresta Ombrófila
Aluvial, e revelou uma grande riqueza de espécies arbóreas, bem
como uma especificidade ambiental em cada formação. A falta de
trabalhos semelhantes voltados para as formações campestres, no
entanto, não permite uma definição acerca da classificação
dos campos encontrados nesta área.
A SN/SF está sob a área de abrangência da Mata Atlântica
e apresenta, nas altitudes mais elevadas, extensos platôs arbustivos e
herbáceos, além de afloramentos rochosos. Sua amplitude altitudinal,
de 900 a 1698 m, aliada às diferenças sucessionais e à
variação nos tipos de solo, principalmente quanto ao seu grau
de hidromorfia, contribui para complexidade de habitats encontrada na região
(Valente 2007). O clima é do tipo Cwb (Köppen), mesotérmico
úmido, com invernos secos e frios e verões brandos e úmidos.
A média da precipitação anual no município, entre
1946 e 2004, foi de 1.886 mm e a mediana de 1.902 mm, segundo dados da Prefeitura
Municipal de Rio Preto.
O inventário florístico da SN/SF foi realizado entre 2004 e 2009,
pela equipe de pesquisadores e estagiários do Departamento de Botânica
da Universidade Federal de Juiz de Fora. Os espécimes coletados foram
depositados no acervo do herbário CESJ (acrônimo segundo Holmgren
et al. 1990).
Análise da similaridade florística
Para comparação da SN/SF com outras formações florestais
e campestres foram selecionadas outras 28 localidades, entre áreas de
Cerrado, Caatinga, Mata Atlântica e Campos Sulinos, distribuídas
pelos estados das Regiões Centro-Oeste, Nordeste, Sudeste e Sul, e cujas
listagens florísticas para Orchidaceae estivessem disponíveis
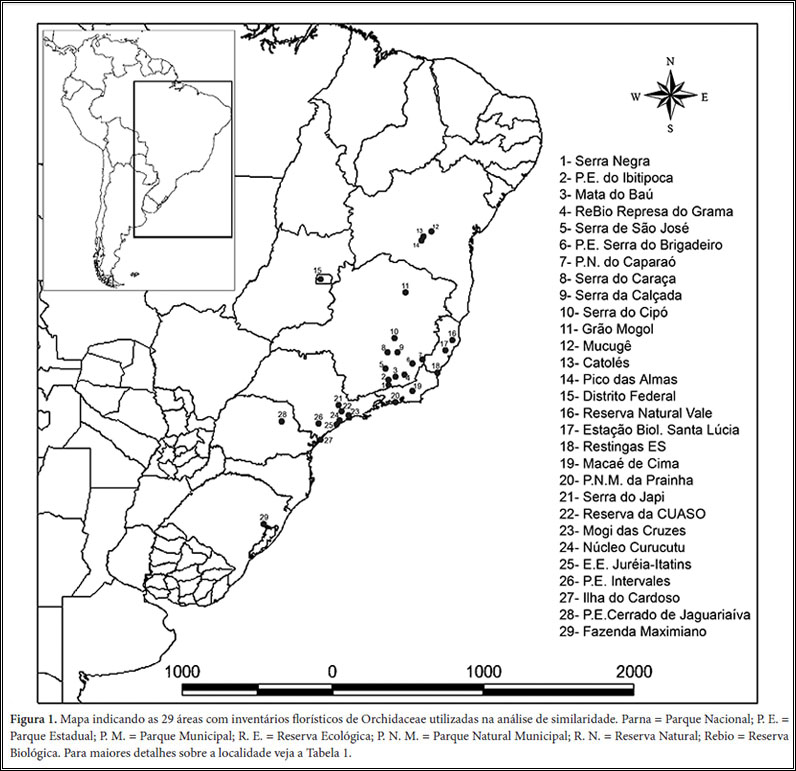
de forma impressa ou digital (Fig. 1; Tab. 1). A classificação
da vegetação adotada segue aquela estabelecida pelos autores de
cada trabalho.
A matriz de similaridade foi baseada nos dados de presença (1) ou ausência
(0) das espécies, organizados em uma planilha, nos diversos locais. As
sinonímias foram verificadas no World Checklist of Monocots (2004). Táxons
infraespecíficos ou sem identificação precisa no nível
de espécie (listados como “sp.”, “cf.” ou “aff.”)
foram excluídos da análise.
A análise de similaridade florística entre as áreas escolhidas
foi realizada no programa PAST (“Paleontological Statistics”), utilizando-se
o coeficiente de Sørensen. Tal coeficiente dá maior peso às
espécies compartilhadas do que àquelas que ocorrem em apenas uma
área (Muller-Dombois & Ellenberg 1974). A partir do cálculo
da similaridade florística, seguiu-se a análise de agrupamento
das áreas utilizando o algoritmo UPGMA (“Unweighted Pair-Group
Method using Arithmetic Averages”) para agrupamento. A união dos
grupos por meio deste algoritmo é baseada no menor valor da distância
média entre agrupamentos através de índices como o de Sørensen
(Shaw 2003). Foram realizadas 5.000 replicações de bootstrap para
calcular o suporte interno dos grupos.
Análise de autocorrelação espacial
Considerando que, em alguns trabalhos, a distância geográfica
é referida apenas descritivamente como uma das explicações
para a similaridade entre áreas (Moreno et al. 2003; Barbero 2007; Munhoz
& Felfili 2007; Silva et al. 2008; Ribeiro-Filho et al. 2009), foi testada
a autocorrelação espacial entre as 29 localidades analisadas neste
trabalho. A localização geográfica das áreas foi
obtida através das coordenadas geográficas indicadas nos trabalhos
ou, quando não relatadas, das coordenadas geográficas dos municípios
(Instituto Brasileiro de Geografia e Estatística; www.ibge. org). Por
meio das coordenadas geográficas foi possível calcular as distâncias
geográficas entre as áreas utilizadas na comparação
florística, por meio do Programa gvSIG.
Para verificar se a distribuição do conjunto de espécies
é afetada pela disposição espacial das áreas, foi
realizado o teste de Mantel no programa PAST.
O teste de Mantel é um método para testar hipóteses em
que as distâncias (ou similaridades) entre objetos na matriz A são
linearmente independentes das distâncias (ou similaridades) entre alguns
objetos na outra matriz B (Dale et al. 2002). Neste trabalho, foram utilizadas
as matrizes de similaridade florística e distância geográfica
entre as áreas com inventários exclusivos de Orchidaceae, ou que
incluíam a família.
Resultados
Foram registradas 109 espécies de Orchidaceae na SN/SF, distribuídas
em 50 gêneros (Tab. 2). A maioria dos gêneros (34) está representada
por apenas uma espécie. Epidendrum L. com 11 espécies,
seguido de Oncidium Sw. s.l. (9 espécies), Maxillaria Ruiz & Pav. s.l. e Habenaria Willd. (8 espécies cada) e Pleurothallis R. Br. s.l. (7 espécies) são os gêneros
mais representativos na área de estudo, perfazendo cerca de 40% das espécies
registradas na região. Analisando a abrangência de distribuição
das espécies inventariadas na SN/SF, observa- se que a grande maioria
delas (ca. 60%) foi registrada entre 5 e 10 áreas, enquanto cerca de
25% foram encontradas entre 1 e 4 áreas, e apenas 14% registradas em
11 ou mais áreas.
Ao todo, 844 espécies compuseram a tabela de presença/ausência
das espécies de Orchidaceae nas 29 áreas analisadas. Poucas espécies
foram registradas em 11 ou mais áreas, são elas: Brassavola
tuberculata, Elleanthus brasiliensis, Encyclia patens, Epidendrum dendrobioides,
Epidendrum proligerum, Epidendrum rigidum, Epidendrum secundum, Eurystyles actinosophila,
Habenaria josephensis, Isochilus linearis, Liparis nervosa, Maxillaria notylioglossa,
Maxillaria ochroleuca, Oeceoclades maculata, Oncidium fl exuosum, Pleurothallis
fusca, Pleurothallis grobyi, Pleurothallis rubens, Pleurothallis saundersiana,
Polystachya estrellensis, Prescottia montana, Prescottia stachyodes, Prosthechea
vespa, Sacoila lanceolata, Sauroglossum nitidum, Scaphyglottis modesta e Zygopetalum
mackayi; apenas quatro delas, não foram encontradas na área
da SN/SF: Brassavola tuberculata Hook., Epidendrum rigidum Jacq., Pleurothallis saundersiana Rchb. f. e Oeceoclades maculata (Lindl.) Lindl.
A análise de agrupamento mostrou alta significância estatística
e o índice de correlação cofenética igual a 0.8614
indicou que a distorção entre a matriz de similaridade e o resultado
final mostrado no dendrograma foi pequena. O grupo formado por SN/SF + Parque
Estadual do Ibitipoca (grupo A) possui o maior valor de similaridade (ca. 0,64),
mas de maneira geral, a análise de agrupamento revelou baixa similaridade
florística entre as áreas (Fig. 2).
A característica mais visível nos grupos representados no dendrograma
é o agrupamento das áreas ocorrentes em um mesmo ecossistema.
Formou-se um grande grupo que engloba áreas sob influência da Mata
Atlântica, em sua maioria compostas de Floresta Ombrófila Densa,
Floresta Estacional Semidecidual e áreas com maior ou menor ocorrência
de ambientes campestres (grupo D). Dentro deste grande grupo é possível
identificar subgrupos, com suporte interno maior, e que também agrupam
áreas semelhantes fisionomicamente e com altitudes equivalentes. O grupo
E engloba as Serras de São José, do Cipó e da Calçada,
todas elas formadas predominantemente por campos rupestres sob influência
do Cerrado; as áreas de campos rupestres com influência da Caatinga
(Parque Municipal de Mucugê, Pico das Almas, Catolés e Grão
Mogol) formam outro grupo (F). Finalmente, as áreas de restingas localizadas
no Espírito Santo e Rio de Janeiro ficaram alojadas em um grupo à
parte (G), e as áreas com predominância de Florestas Estacionais
Semideciduais em outro grupo (H) (Fig. 2).
Uma análise de agrupamento aglomerativa (aglomerative clustering) toma
diversas observações separadas e as agrupa sucessivamente em grupos
maiores, até um “cluster” ser obtido (Gotelli & Ellison
2004). Assim, pode-se observar que a SN/SF apresenta maior índice de
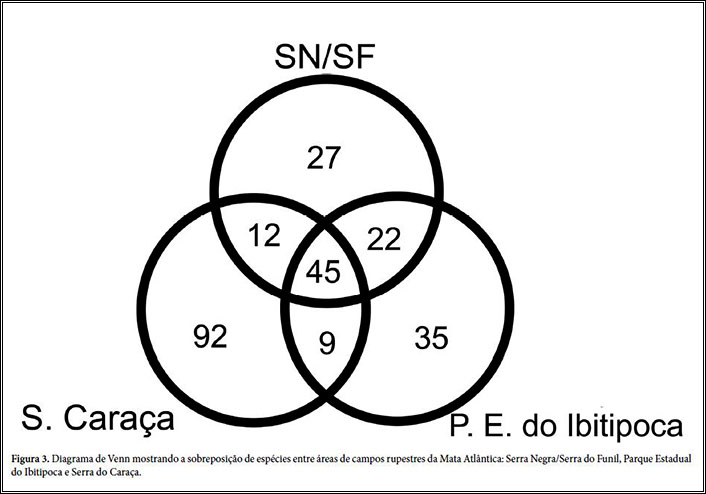
similaridade com Ibitipoca (ca. 0,64) (Fig. 2) e possui 63% de suas espécies
em comum com esta área (Fig. 3). Quando as relações florísticas
da SN/SF são vistas
em um contexto mais amplo, analisando o grupo B, observa-se que uma porcentagem
um pouco menor de suas espécies (54%) são compartilhadas com a
Serra do Caraça.
Este agrupamento revela uma porcentagem muito alta de espécies exclusivas
da Serra do Caraça em relação à SN/SF e ao Parque
Estadual do Ibitipoca, e ainda, 45 espécies compartilhadas entre os três
grupos (Fig. 3). O teste de Mantel revelou que a similaridade florística
não está associada com a distância geográfica entre
as regiões (p = 0.9998, r = -0.3687).
Discussão
Dentre as espécies que ocorrem em mais de dez áreas, pode-se
observar que a maioria possui ampla distribuição nas Américas,
sendo capazes de colonizar áreas florestais e campestres, como é
o caso de Epidendrum secundum, Liparis nervosa e Oncidium flexuosum.
Segundo Giulietti et al. (1987) e Giulietti & Pirani (1988), os elementos
predominantemente florestais tendem a apresentar distribuição
mais ampla e, pelo fato de colonizarem tanto ambientes abertos como florestais,
podem encontrar mais oportunidades de dispersão. Por outro lado, as espécies
que ocorrem em mais de dez áreas e apresentaram distribuição
em território brasileiro, estão em sua maioria limitadas às
Regiões Sul e Sudeste (Pabst & Dungs 1975, 1977). Em parte, isto
pode ser reflexo do desconhecimento da flora nas demais Regiões do país.
Muito embora o conhecimento sobre as angiospermas tenha aumentado muito desde
o século passado no Brasil, ainda são necessárias coletas
mais intensivas em áreas montanas, áreas com sazonalidade bem
marcada, florestas semideciduais, Pantanal e Amazônia (Giulietti et al.
2005).
Tabela 1. Lista das 29 localidades incluídas na análise de similaridade
florística de Orchidaceae, incluindo número de espécies
de Orchidaceae (N. spp.), bioma e ecossistemas predominantes na área,
altitudes e referências bibliográficas para as respectivas fontes
de dados. Para a distribuição geográfica das localidades
veja a Fig. 1.
| Localidade |
N.spp. |
Bioma |
Ecossistema |
Altitude (m) |
Referências |
| 1. Serra Negra – MG |
109 |
Mata Atlântica |
Floresta Ombrófila Densa/
campo rupestre |
900-1.670 |
Presente estudo |
| 2. Parque Estadual do Ibitipoca – MG |
118 |
Mata Atlântica |
Floresta Ombrófila Densa/
campo rupestre |
1200-1.784 |
Menini Neto et al. 2007 |
| 3. Mata do Baú – MG |
44 |
Cerrado |
Floresta Estacional
Semidecidual/ campo-cerrado |
900-1.200 |
Menini Neto et al. 2004 a |
| 4. Reserva Biológica da Represa do Grama – MG |
28 |
Mata Atlântica |
Floresta Estacional
Semidecidual |
750 |
Menini Neto et al. 2004 b |
| 5. Serra de São José – MG |
106 |
Cerrado |
Campo rupestre/ campo
cerrado |
900-1.426 |
Alves & Kolbek 2009 |
6. Parque Estadual da Serra do
Brigadeiro – MG |
106 |
Mata Atlântica |
Floresta Pluvial Atlântica/
campo de altitude |
900-1.980 |
Leoni & Tinte 2004 |
| 7. Parque Nacional do Caparaó – MG/ES |
86 |
Mata Atlântica |
Floresta Pluvial Atlântica/
campo de altitude |
1.300-2.890 |
Leoni 1997 |
| 8. Serra do Caraça – MG |
182 |
Mata Atlântica |
Campo rupestre/ Floresta
Estacional Semidecidual |
750-2.072 |
Mota 2006 |
| 9. Serra da Calçada – MG |
18 |
Cerrado |
Campo rupestre |
900-1.426 |
Viana & Lombardi 2007 |
| 10. Serra do Cipó – MG |
80 |
Cerrado |
Campo rupestre |
1.200 |
Barros 1987 |
| 11. Grão Mogol – MG |
30 |
Cerrado/Caatinga |
Campo rupestre |
700-1.295 |
Barros & Pinheiro 2004 |
| 12. Pico das Almas – BA |
46 |
Caatinga |
Campo rupestre |
1.000-1.958 |
Toscano-de-Brito 1995 |
| 13. Catolés – BA |
76 |
Cerrado/Caatinga |
Campo rupestre |
900-1.958 |
Zappi et al. 2003 |
| 14. Parque Municipal de Mucugê – BA |
35 |
Caatinga |
Campo rupestre |
1.000 |
Azevedo & Van den Berg 2007 |
| 15. Reserva Ecológica do Guará – DF |
100 |
Cerrado |
Campo-cerrado |
1.000 |
Batista et al. 2005 |
| 16. Reserva Natural Vale – ES |
94 |
Mata Atlântica |
Floresta Estacional
Semidecidual/ campos nativos |
28-65 |
Fraga et al. (dados não
publicados) |
| 17. Estação Biológica Santa Lúcia –
ES |
160 |
Mata Atlântica |
Floresta Ombrófila Densa |
600-900 |
Romagna (dados não
publicados) |
| 18. Restingas do Estado do Espírito Santo – ES |
71 |
Mata Atlântica |
Restinga |
0 |
Fraga & Peixoto 2004 |
19. Reserva Biológica de Macaé de
Cima – RJ |
247 |
Mata Atlântica |
Floresta Pluvial Atlântica |
1.200-1.600 |
Miller & Warren 1994 |
| 20. Parque Natural Municipal da Prainha – RJ |
26 |
Mata Atlântica |
Floresta Ombrófila Densa
Submontana |
0-45 |
Cunha & Forzza 2007 |
21. Serra do Japi – SP
|
125 |
Mata Atlântica/
Cerrado |
Floresta Estacional
Semidecidual |
700-1.300 |
Pansarin & Pansarin 2008 |
| 22. Parque Nacional do Itatiaia – RJ |
158 |
Mata Atlântica |
Campo de altitude |
650-2.780 |
www.jbrj.gov.br (banco de dados JABOT) |
| 23. Parque Natural Municipal Francisco Afonso de Mello – SP |
67 |
Mata Atlântica |
Floresta Ombrófila Densa |
807-1.141 |
Rodrigues 2008 |
| 24. Núcleo Curucutu do Parque Estadual da Serra do Mar –
SP |
25 |
Mata Atlântica |
Campo de Altitude |
750-850 |
Garcia & Pirani 2005 |
| 25. Estação Ecológica Juréia-Itatins –
SP |
70 |
Mata Atlântica |
Floresta Ombrófi la Densa/
restinga |
0-1240 |
Catharino & Barros 2004 |
26. Parque Estadual Intervales
(Base Saibadela) – SP
|
13 |
Mata Atlântica |
Floresta Ombrófila Densa/ Floresta Estacional Semidecidual |
70-250 |
Zipparro et al. 2005 |
| 27. Parque Estadual da Ilha do Cardoso – SP |
139 |
Mata Atlântica |
Floresta Ombrófila Densa |
0-800 |
Romanini & Barros 2007 |
| 28. Parque Estadual do Cerrado – PR |
13 |
Cerrado |
Campo-cerrado |
800-900 |
Von Linsingen et al. 2006 |
| 29. Fazenda São Maximiano – RS |
50 |
Mata Atlântica/ Campos
Sulinos |
Floresta Estacional
Semidecidual Submontana |
198 |
Buzatto et al. 2007 |
Tabela 2. Lista das espécies de Orchidaceae encontradas nas Serras Negra
e do Funil, Município de Rio Preto, Minas Gerais, Brasil.
| Espécies |
Material Testemunho |
| Aspidogyne commelinoides (Barb. Rodr.) Garay |
N.L. Abreu 67 |
| Aspidogyne hylibates (Rchb. f.) Garay |
F.R.G. Salimena 991 |
| Bifrenaria aureofulva Lindl. |
N.L. Abreu 197 |
| Bifrenaria harrisoniae (Hook.) Rchb. f. |
N.L. Abreu 101 |
| Bifrenaria stefanae V. P. Castro |
N.L. Abreu 94 |
| Bifrenaria vitellina (Lindl.) Lindl. L. |
Menini Neto 276 |
| Bulbophyllum exaltatum Lindl. |
A.S.M. Valente 351 |
| Bulbophyllum granulosum Barb. Rodr. |
L.Menini Neto 256 |
| Bulbophyllum luederwaldtii Hoehne & Schltr. |
N.L. Abreu 92 |
| Campylocentrum linearifolium Schltr. ex Mansf. |
N.L. Abreu 294 |
| Catasetum cernuum (Lindl.) Rchb. f. |
L. Menini Neto 179 |
| Cattleya loddigesii Lindl. |
L. Menini Neto 400 |
| Cirrhaea sp. |
L. Menini Neto 656 |
| Cleistes gracilis Schltr. |
N.L. Abreu 173 |
| Cleistes moritzii (Rchb. f.) Garay & Dunst. |
N.L. Abreu 7 |
| Comparettia coccinea Lindl. |
N.L. Abreu 166 |
| Cranichis candida (Barb. Rodr.) Cogn. |
N.L. Abreu 100 |
| Cyclopogon warmingii (Rchb. f.) Schltr. |
N.L. Abreu 78 |
| Cyrtopodium glutiniferum Raddi |
N.L. Abreu 271 |
| Dichaea cf. anchorifera Cogn. |
C.N. Matozinhos 23 |
| Dichaea cogniauxiana Schltr. |
N.L. Abreu 103 |
| Elleanthus brasiliensis (Lindl.) Rchb. f. |
N.L. Abreu 72 |
| Encyclia patens Hook. |
F.R.G. Salimena 1309 |
| Epidendrum armeniacum Lindl. |
J.H.C. Ribeiro 226 |
| Epidendrum avicula Lindl. |
F.R.G. Salimena1308 |
| Epidendrum chlorinum Barb. Rodr. |
N.L. Abreu 200 |
| Epidendrum dendrobioides Thunb. |
N.L. Abreu 298 |
| Epidendrum densiflorum Hook. |
N.L. Abreu 80 |
| Epidendrum difforme Jacq. |
N.L. Abreu 110 |
| Epidendrum latilabre Lindl. |
N.L. Abreu 264 |
| Epidendrum martianum Lindl. |
L. Menini Neto 279 |
| Epidendrum paranaense Barb. Rodr. |
P.L. Viana 1957 |
| Epidendrum proligerum Barb. Rodr. |
N.L. Abreu 286 |
| Epidendrum ramosum Jacq. |
P.L. Viana 2015 |
| Epidendrum secundum Jacq. |
N.L. Abreu 8 |
| Eurystyles actinosophila (Barb. Rodr.) Schltr. |
L. Menini Neto 431 |
| Gomesa recurva R. Br. N.L. |
Abreu 60 |
| Grobya amherstiae Lindl. |
L. Menini Neto 262 |
| Habenaria josephensis Barb. Rodr. |
A.L. Santiago 29 |
| Habenaria macronectar (Vell.) Hoehne |
F.R.G. Salimena 2369 |
| Habenaria parviflora Lindl. |
L. Menini Neto 293 |
| Habenaria petalodes Lindl. F.R.G. |
Salimena 2412 |
| Habenaria pseudoglaucophylla J.A.N Batista R. Mota & N. Abreu |
N.L. Abreu 73 |
| Habenaria rodeiensis Barb. Rodr. |
N.L. Abreu 143 |
| Habenaria rolfeana Schltr. |
N.L. Abreu 183 |
| Habenaria warmingii Rchb. f. & Warm. |
L.C.S. Assis 980 |
| Hadrolaelia coccinea (Lindl.) Chiron & V. P. Castro |
N.L. Abreu 210 |
| Hoffmannseggella crispata (Thunb.) H.G. Jones |
L. Menini Neto 398 |
| Isabelia violacea (Lindl.) C. van den Berg & M.W. Chase |
F.S. Souza 748 |
| Isochilus linearis (Jacq.) R. Br. |
N.L. Abreu 82 |
| Lankesterella ceracifolia (Barb. Rodr.) Mansf. |
P.L. Viana 1903 |
| Liparis nervosa (Thunb.) Lindl. |
N.L. Abreu 306 |
| Malaxis parthonii C. Morren |
L. Menini Neto 273 |
| Masdevallia infracta Lindl. |
N.L. Abreu 296 |
| Maxillaria acicularis Herb. ex Lindl. |
A.L. Santiago 5 |
| Maxillaria bradei Schltr. ex Hoehne |
N.L. Abreu 43 |
| Maxillaria brasiliensis Brieger & Illg |
N.L. Abreu 285 |
| Maxillaria madida Lindl. |
A.L. Santiago 2 |
| Maxillaria notylioglossa Rchb. f. |
N.L. Abreu 280 |
| Maxillaria ochroleuca Lodd. ex Lindl. |
N.L. Abreu 284 |
| Maxillaria picta Hook. |
N.L. Abreu 323 |
| Maxillaria rigida Barb. Rodr. |
L. Menini Neto 305 |
| Mesadenus glaziovii (Cogn.) Schltr. |
L. Menini Neto 364 |
| Octomeria alpina Barb. Rodr. |
N.L. Abreu 68 |
| Octomeria diaphana Lindl. |
L. Menini Neto 433 |
| Octomeria grandiflora Lindl. |
A.L. Santiago 24 |
| Octomeria wawrae Rchb. f. ex Wawra |
S.A. Roman 78 |
| Oncidium blanchetii Rchb. f. |
N.L. Abreu 304 |
| Oncidium divaricatum Lindl. |
N.L. Abreu 273 |
| Oncidium flexuosum Lodd. |
C.N. Matozinhos 81 |
| Oncidium forbesii Hook. |
L.Menini Neto 300 |
| Oncidium gardneri Lindl. |
L.Menini Neto 680 |
| Oncidium hookeri Rolfe . |
L.Menini Neto 399 |
| Oncidium pubes Lindl. |
L.Menini Neto 397 |
| Oncidium truncatum Pabst |
L.Menini Neto 245 |
| Oncidium warmingii Rchb. f. |
N.L. Abreu 171 |
| Pabstia jugosa (Lindl.) Garay |
P.L. Viana 1905 |
| Pleurothallis fusca Lindl. |
N.L. Abreu 5 |
| Pleurothallis grobyi Bateman ex Lindl. |
N.L. Abreu 98 |
| Pleurothallis micrantha Barb. Rodr. |
L. Menini Neto 476 |
| Pleurothallis modestissima Rchb. f. & Warm. |
N.L. Abreu 95 |
| Pleurothallis rubens Lindl. |
N.L. Abreu 113 |
| Pleurothallis tricarinata Poepp. & Endl. |
J.H.C. Ribeiro 138 |
| Pogoniopsis cf. nidus-avis Rchb. f. |
A.L. Santiago 11 |
| Polystachya estrellensis Rchb. f. |
L. Menini Neto 232 |
| Polystachya hoehneana Kraenzl. |
N.L. Abreu 305 |
| Prescottia montana Barb. Rodr. |
F.R.G. Salimena 1329 |
| Prescottia phleoides Lindl. |
F.S. Souza 486 |
| Prescottia stachyodes (Sw.) Lindl. |
L. Menini Neto 233 |
| Promenaea xanthina (Lindl.) Lindl. |
N.L. Abreu 295 |
| Prosthechea allemanoides (Hoehne) W.E. Higgins |
N.L. Abreu 288 |
| Prosthechea calamaria (Lindl.) W.E. Higgins |
A.L. Santiago 3 |
| Prosthechea vespa (Vell.) W.E. Higgins |
N.L. Abreu 28 |
| Rodrigueziella gomezoides (Barb. Rodr.) Berman |
N.L. Abreu 61 |
| Sacoila lanceolata (Aubl.) Garay |
C.N. Matozinhos 54 |
| Sarcoglottis umbrosa (Barb. Rodr.) Schltr. |
A.L. Santiago 12 |
| Sauroglossum nitidum (Vell.) Schltr. |
F.S. Souza 286 |
| Scaphyglottis modesta (Rchb. f.) Schltr. |
N.L. Abreu 318 |
| Scuticaria strictifolia Hoehne |
N.L. Abreu 172 |
| Sophronitis cernua Lindl. |
E.A. Feliciano 40 |
| Stelis aprica Lindl. |
A.L. Santiago 23 |
| Stelis intermedia Poepp. & Endl. |
L.Menini Neto 234 |
| Stelis megantha Barb. Rodr. N |
Abreu 93 |
| Stelis papaquerensis Rchb. f. |
L. Menini Neto 235 |
| Stigmatosema polyaden (Vell.) Garay |
N.L. Abreu 77 |
| Warrea warreana (Lodd. ex Lindl.) C. Schweinf. |
L. Menini Neto 390 |
| Zygopetalum mackayi Hook. |
N.L.Abreu 15 |
| Zygopetalum maxillare Lodd. L. |
Menini Neto 593 |
| Zygopetalum triste Barb. Rodr. |
A.L. Santiago 9 |
| |
|
Os baixos valores de similaridade encontrados neste estudo sugerem haver particularidades
florísticas em cada área, o que é justificado pelo número
baixo de espécies compartilhadas, reafirma a grande riqueza de Orchidaceae
encontrada no território brasileiro. Resultados semelhantes
foram encontrados em estudos com Orchidaceae e outros grupos de plantas, mesmo
para um número menor de áreas localizadas em um mesmo espectro
ambiental (Meira-Neto & Martins 2002; Azevedo & van den Berg 2007; Barbero
2007; Munhoz & Felfili 2007; Silva et al. 2008; Menini Neto et al. 2009).
Estes resultados reforçam a relevância da criação
de novas unidades de conservação, a fim de se preservar a riqueza
da flora brasileira como um todo.
A SN/SF apresenta maior similaridade com duas áreas em que predominam
campos rupestres (grupo B): Ibitipoca, com o qual possui alta similaridade,
e Caraça. Em 76% das reamostragens realizadas pelo teste de bootstrap,
o grupo B, apresentou-se nessa mesma posição, indicando alto suporte
interno. Cerca de 40% das espécies compartilhadas entre estas três
áreas possuem ampla distribuição no Brasil, como Elleanthus
brasiliensis, Epidendrum secundum, Maxillaria notylioglossa e Sacoila
lanceolata (Pabst & Dungs 1975, 1977). As demais espécies são
encontradas principalmente em áreas de campos rupestres ou de campos
de altitude, e Floresta Ombrófila, refletindo as características
fisionômicas encontradas nas áreas do grupo B (Fig. 2), que são
compostas por um mosaico formado por áreas campestres e fragmentos de
Floresta Ombrófila. O termo campo rupestre foi proposto por Joly (1970),
que associou esta vegetação às rochas quártzicas.
No entanto, a classificação da vegetação campestre
encontrada nas serras do sudeste e sul de Minas Gerais ainda causa discordância
(Rizzini 1979; Ferri 1980; Eiten 1983; Semir 1991; Veloso 1991; Oliveira-Filho
2009). Embora os campos rupestres sejam fisionomicamente semelhantes aos campos
de altitude, eles diferem quanto à composição florística,
à associação com as formações vegetacionais
do entorno, e principalmente, quanto à litologia, de modo que, após
o trabalho de Joly (1970), diversos autores (Rizzini 1979; Ferri 1980; Semir
1991; Benites et al. 2003) sugeriram classifi cações buscando
diferenciar as formações sobre quartzito daquelas sobre granito.
Os resultados apresentados neste trabalho podem, juntamente com a análise
florística que está em andamento e futuros estudos pedológicos,
subsidiar conclusões acerca do enquadramento dos campos encontrados na
área foco deste estudo.
Outros dois estudos considerando a flora arbórea/arbustiva visaram identificar
as relações florísticas da SN/SF com outras áreas.
Mesmo utilizando o índice de Sørensen e o método UPGMA
para agrupamento, tais trabalhos apresentaram relações distintas
das encontradas no presente estudo. Os resultados de Feliciano (2008) mostraram
que a flora de Solanaceae da SN/SF aparece mais próxima a das áreas
com formação de Floresta Ombrófila Densa, embora com baixos
valores de similaridade. Valente (2007) encontrou maior similaridade da flora
arbórea da SN/SF com áreas localizadas na Zona da Mata mineira
(Lima Duarte e Juiz de Fora). No entanto, o presente estudo e os dois trabalhos
supracitados trataram de grupos de plantas diferentes e utilizaram métodos
de análise distintos, podendo ser estas possíveis explicações
para a obtenção de resultados diferentes em cada estudo. Enquanto
Valente (2007) tratou da flora arbórea, mas restringindo-se a três
fragmentos florestais da SN/SF, Feliciano (2008) focou Solanaceae na área
como um todo, apesar da predominância das espécies em áreas
florestais.
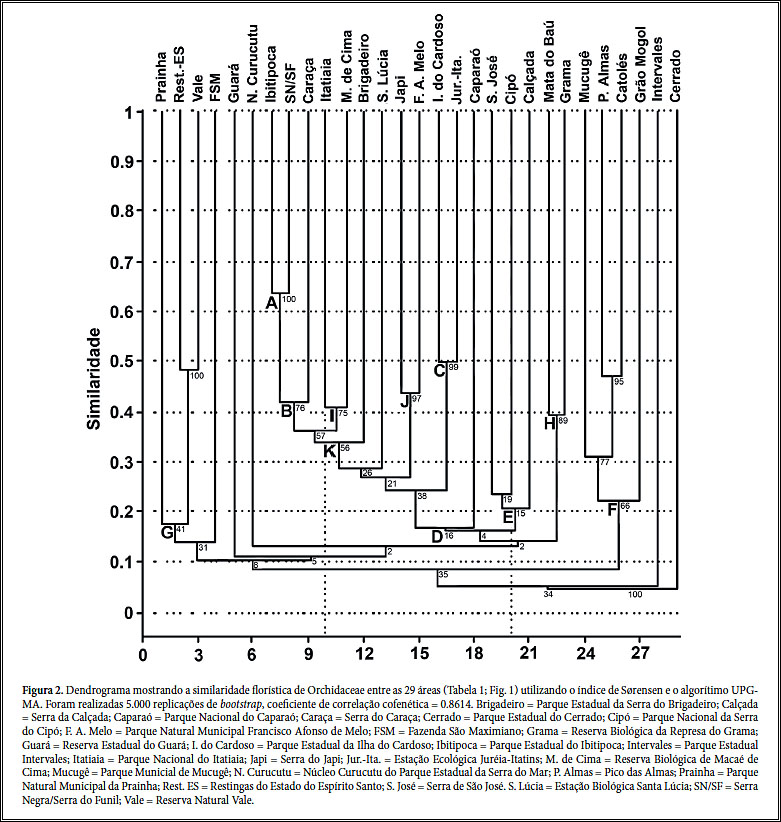
Outros grupos, formados por áreas semelhantes em termos de fisionomia
e altitude, foram identifi cados no grande agrupamento que engloba áreas
sob o Domínio Janeiro, apresentam áreas de Floresta Ombrófila
Densa, e altitudes superiores a 1.200 m. A Serra do Japi e o Parque Natural
Municipal Francisco Afonso de Mello, no Estado de São Paulo, também
são áreas florestais, porém com altitude máxima
de 1.300 m. O Parque Estadual da Ilha do Cardoso e a Estação Ecológica
Juréia-Itatins não ultrapassam 1.200 m e possuem um mosaico vegetacional
composto por restingas, campos e áreas florestais.
Localidades em que a flora de Orchidaceae é distinta, ou seja, com similaridade
baixa em relação a outros grupos formados foram reveladas, como
a Reserva Ecológica do Guará, localizada no Cerrado, mas que não
se agrupa com as outras áreas deste Bioma. Este fato pode ser justifi
cado pela falta de campos rupestres em Guará, diferentemente da predominância
deles nas demais áreas do Cerrado análisadas. As áreas
de restinga também se agruparam em um ramo distinto das outras áreas
da Mata Atlântica. Este tipo de vegetação ocorre ao nível
do mar e é constituído por uma grande variedade de comunidades
de plantas, em decorrência da topografia distinta e da combinação
de variáveis ambientais de origem continental e oceânica (Flexor
et al. 1984; Suguio & Tessler 1984). Este resultado reforça a conclusão
de que a heterogeneidade de habitats na Mata Atlântica pode ter tido um
papel importante na diversificação e nos endemismos de sua flora
(Fiaschi & Pirani 2009).
Diversos autores propuseram a existência de um padrão de distribuição
disjunta entre os campos rupestres e as restingas (Giulietti & Pirani 1988;
Harley 1995; Alves et al. 2007), o que seria explicado pelas características
ambientais comuns entre as áreas analisadas, neste caso, a drenagem do
solo e conseqüente pobreza de nutrientes (Alves et al. 2007). Neste trabalho,
as restingas se ligam aos grupos que incluem as áreas de campos rupestres,
com baixo valor de similaridade, indicando que os padrões indicados pelos
autores supracitados não se confirmam quando analisadas apenas as espécies
de Orchidaceae (Fig. 2). Segundo Alves et al. (2007), o padrão de distribuição
campo rupestrerestinga se mostrou válido para uma porcentagem muito baixa
das espécies citadas na literatura com este padrão de distribuição.
Neste trabalho, não foram analisados apenas inventários destinados
exclusivamente a Orchidaceae. Assim, o esforço de amostragem destinado
à família também pode ser uma explicação
para alguns valores de similaridade baixos, como: o Parque Estadual do Cerrado,
única área localizada no Paraná, e composta por vegetação
de cerrado; Parque Estadual Intervales, que não se agrupou com outras
áreas de Floresta Ombrófila do Estado de São Paulo; e o
Núcleo Curucutu do Parque Estadual da Serra do Mar, com presença
de campos de altitude.
A localização dos campos rupestres em áreas com predominância
de diferentes biomas em ramos distintos do dendrograma abre espaço para
a discussão sobre a riqueza e a particularidade florística desta
fi sionomia e a infl uência climática sobre a flora. Os grupos
formados pelos campos rupestres do Cerrado e da Caatinga, não possuem
alta similaridade florística entre si, nem com outros grupos. Apenas
os campos rupestres da Mata Atlântica possuem alguma similaridade com
Itatiaia e Macaé de Cima, visto que a SN/SF comporta-se como corredor
florístico entre o Maciço do Itatiaia e Ibitipoca (Valente 2007).
As diferenças na composição florística entre as
porções mineira e baiana da Cadeia do Espinhaço já
haviam
sido discutidas em outros trabalhos (Harley 1988, 1995; Rapini et al. 2002;
Azevedo & van den Berg 2007), sugerindo a existência de uma barreira
migratória para as espécies entre essas duas porções
da Cadeia (Harley 1988). O presente trabalho encontrou resultados semelhantes
aos apresentados por Azevedo & van den Berg (2007) para a fl ora de Orchidaceae
nas áreas da Cadeia do Espinhaço. Em ambos os casos, a porção
baiana, sob infl uência da Caatinga (Catolés, Mucugê e Pico
das Almas) forma um grupo coeso, separado das áreas de campos rupestres
do Cerrado, enquanto Grão Mogol apresenta uma flora intermediária
entre os dois grupos.
Os campos rupestres nos estados de Minas Gerais, Bahia e Goiás aparecem
como formações individualizadas, geralmente em altitudes superiores
a 900 m, e com distribuição descontínua (Giulietti &
Pirani 1988; Harley 1995; Drummond et al. 2005). O solo arenoso e bem drenado
parece ser a característica ambiental determinante na distribuição
disjunta das espécies ocorrentes nos campos rupestres e em outras localidades
“ilha”, como as campinaranas amazônicas, algumas áreas
nas Guianas e áreas montanhosas e planícies do Nordeste (Barros
1998). Áreas acima de 1.000 m de altitude, onde ocorrem os campos rupestres,
são consideradas prioritárias para a conservação
(Drummond et al. 2005), pois apresentam alta incidência de espécies
endêmicas, adaptadas às suas condições distintas
de temperatura, precipitação e insolação (Menezes
& Giulietti 2000).
A distância geográfica entre as áreas não influenciou
a similaridade florística de Orchidaceae, resultado semelhante ao encontrado
por Meira-Neto & Martins (2002) e Gomes et al. (2004), cada qual utilizando
metodologias distintas para avaliar esta relação. Outros trabalhos
recorrem a fatores, diferentes da distância geográfica entre as
áreas, para explicar a similaridade florística. Moreno et al.
(2003) atribuíram a similaridade entre áreas de Mata Atlântica
no estado do Rio de Janeiro à altitude, enquanto Silva et al. (2008)
consideraram a heterogeneidade de ambientes o fator determinante na similaridade
entre áreas de cerrado do Maranhão; no entanto, a relação
entre similaridade florística e distância geográfica não
foi estatisticamente testada em nenhum dos dois trabalhos. Segundo Tuomisto
et al. (2003), devido à dispersão anemocórica dos esporos
de Pteridophyta, a distância geográfica não seria uma barreira
para a distribuição das espécies entre áreas; a
proximidade das condições ambientais entre a área matriz
e a área a ser colonizada é que determinariam o estabelecimento
de novas plantas. De maneira semelhante, Menini Neto et al. (2009) concluíram
que a composição da flora epifítica nas Regiões
Sudeste e Sul tem maior influência da dispersão predominantemente
anemocórica do que da distância geográfica entre as áreas.
As sementes de Orchidaceae, com raras exceções são desprovidas
de endosperma, e possuem tamanhos diminutos (0,15-6 mm), sendo facilmente dispersadas
pelo vento; elas se desenvolvem dentro de cápsulas que produzem no mínimo
6.000 sementes, em espécies terrícolas, e centenas de milhares
de sementes em espécies epífitas (Pridgeon et al. 1999). No entanto,
a distribuição de Orchidaceae parece ser definida por uma adaptação
limitada pelo clima e fatores ecológicos, o que impede a livre disseminação
de suas espécies (Sanford 1974), já que o estabelecimento de uma
planta em uma nova área necessita de condições físicas
que permitam a ocorrência do fungo específico com o qual suas sementes
formaram uma micorriza (Dressler 1981).
Com relação às Orchidaceae, fi cou estatisticamente comprovada
a não influência da distância geográfica na similaridade
florística entre as áreas analisadas neste estudo. Mesmo o dendrograma
tendo indicado maior similaridade entre áreas com tipos vegetacionais
e altitudes semelhantes, estes fatores não devem ser considerados os
únicos na determinação da similaridade florística
entre áreas. Estudos biogeográficos indicam padrões de
disjunção entre os campos rupestres e as restingas (Alves et al.
2007), entre a Floresta Atlântica e a Amazônia e entre afl oramentos
rochosos na Floresta Atlântica e/ou montanhas do Cerrado (Fiaschi &
Pirani 2009). Estudos mais detalhados em relação à influência
de fatores bióticos e abióticos poderão apontar com mais
precisão fatores causais para a similaridade florística entre
essas áreas.
Agradecimentos
Os autores agradecem à Universidade Federal de Juiz de Fora; ao Programa
de Pós Graduação em Ecologia da UFJF; e à Fundação
de Amparo a Pesquisa do Estado de Minas Gerais (Fapemig) pela concessão
de auxílio aos projetos de estudos florísticos na Serra Negra
(CRA 1891/06 e CRA 1810-5.02/07).
Versão eletrônica do artigo em www.scielo.br/abb e http://www.botanica.org.br/acta/ojs
(1) Universidade Federal de Juiz de Fora, Programa de Pós-Graduação
em Ecologia, Juiz de Fora, MG, Brasil
(2) Centro de Ensino Superior de Juiz de Fora, Campus Arnaldo Jannsen, Juiz de
Fora, MG, Brasil
(3) Universidade Federal do Rio de Janeiro, Núcleo de Pesquisa em Ecologia
e Desenvolvimento Sócio-Ambiental de Macaé, Rio de Janeiro, RJ,
Brasil
(4) Autor para correspondência: narjara.lopes@gmail.com
Fotos e bibliografia na página seguinte

|