| 
Brittonia, vol 56 (3) - 260.274, 2004

Fig. 1 |
Cyrtopodium
brunneum
A.
Habito durante a antese.
B. Flor, vista frontal.
C. Flor, vista lateral.
D. Calo.
E. Perianto.
a-e. Variações na morfologia do labelo, cada
labelo proveniente de um exemplar diferente da mesma população.
A-D desenhados a partir de Batista 1242,
E & a-e desenhados a partir de Batista 208 por Simone
C. Souza e Silva. |
RESUMO. Cyrtopodium
brunneum, C. lamellaticallosum e C. poecilum
var. roseum, duas novas espécies e uma nova variedade
de orquídeas do cerrado e campos rupestres do centro-oeste
e sudeste do Brasil são descritas e ilustradas. Embora
a descrição do Cyrtopodium gonzalezii indique
tratar-se de uma espécie distinta, o holótipo é
indubitavelmente um exemplar de C. brandonianum. Esta espécie
é descrita aqui como C. brunneum e C. gonzalezii
é considerado como sinônimo do C. brandonianum.
Palavras
chave: Orchidaceae, Cyrtopodium, cerrado, Brasil.
Cyrtopodium
é um gênero Neotropical com cerca de 42 espécies
distribuídas do sul da Flórida ao norte da Argentina.
O centro de diversidade do gênero é o Cerrado brasileiro,
onde ocorrem ao menos 25 espécies. Nos últimos anos,
espécies novas foram descritas para o gênero (Bianchetti
& Batista, 2000; Menezes, 2000; Batista & Bianchetti,
2001), e a maioria ocorrendo no Brasil central. Baseados na exploração
da região e no exame de material herborizado, duas novas
espécies (C. brunneum e C. lamellaticallosum)
e uma nova variedade (C. poecilum var. roseum) foram
descobertos e são descritos abaixo.
Tradicionalmente, a taxonomia de Cyrtopodium foi baseada
quase completamente nos caracteres reprodutivos, sendo a parte
vegetativa, as folhas em particular, negligenciada. Isso se deve
ao fato de que os estudos botânicos foram realizados principalmente
a partir de exemplares herborizados (secos) e coletados durante
o período de floração quando a maioria das
espécies de Cyrtopodium não apresenta folhas
completamente desenvolvidas. O exame de plantas vivas ao longo
de todo o seu ciclo de desenvolvimento nos permitiu a caracterização
da parte vegetativa da maioria das espécies e, em muitos
casos, a parte vegetativa é suficientemente distinta para
permitir a identificação das espécies. Baseado
nesta caracterização, o holótipo do C.
gonzalezii L.C.Menezes é indubitavelmente um exemplar
de C. brandonianum Barb.Rodr., embora a descrição
indique que se trata de uma espécie nova. Esta nova espécie
é descrita aqui como C. brunneum.
Tipo:
BRASIL. Distrito Federal, Brasília, Plano Piloto, final
da Asa Norte, área entre o Parque Ecológico Norte
e o Parque Nacional de Brasília, área do futuro
setor Noroeste, 8 Set. 2001 (fl), J.A.N. Batista 1242 (HOLÓTIPO:
CEN; ISÓTIPOS: AMES, BHCB, CEPEC, HB, HUEFS, K, MBM, MO,
NY, R, RB, SP, UB, UEC).
Cyrtopodium
gonzalezii L.C.Menezes in Boletim CAOB 6(1): 9. 1995. pro
parte incluindo a descrição, excluindo o tipo.
Cyrtopodio
tristi Rchb. f. & Warm. similis sed inflorescentia semper
simplici, floribus minoribus, sepalis oblongo-lanceolatis vel
paulo lanceolato-ovatis, labelli lobis lateralibus falcatis differt;
etiam C. dusenii Schltr. similis sed foliis sub anthesi redactis,
inflorescentia semper simplici, floribus majoribus, sepalis et
petalis atrobrunneis differt.
Erva terrestre. Pseudobulbos completamente enterrados, pequenos,
ovais, desprovidos de folhas a partir do segundo ano, externamente
brancos, (3)4-6(7) x (1)1.5-2.5 cm. Raízes numerosas, esbranquiçadas,
glabras. Folhas na antese 3-6, pouco desenvolvidas, 7-15 cm compr.,
quando completamente desenvolvidas 5-8, patentes, coriáceas,
lanceoladas, as 1-2 basais, em forma de bainhas, as 4-7 apicais,
13-33 x 1-2.6 cm, articuladas, articulação 1-2 cm
da superfície do solo, ápice acuminado. Inflorescência
lateral, ereta, racemosa, laxa, 26-56 cm, marrom-claro a marrom-escuro;
pedúnculo 11-26 cm com 2 brácteas em forma de bainhas,
fortemente adpressas, 1.7-3.5 cm compr.; raquis 12-26 cm compr.;
brácteas florais oblongo-lanceoladas, mais curtas do que
o ovário e pedicelo, 10-30 x 5-9 mm, agudas a acuminadas,
margens onduladas, involutas, verde-amarronzado; ovário
e pedicelo 1.4-3.9 cm compr., marrom-escuro. Flores 9-15(20),
pequenas, com perfume adocicado. Sépalas oblongo-lanceoladas
a ligeiramente lanceolado-ovadas, ápice apiculado, margem
ondulada, marrom-claro a escuro ou marrom-esverdeadas, base mais
clara, freqüentemente com pintas marrom escuro; sépala
dorsal (8)11-13(15) x 4-5(6) mm; sépalas laterais ligeiramente
oblíquas, (8)11-13(15) x 4-6(7) mm. Pétalas largo-elípticas
a largo-lanceoladas, ápice obtuso a rotundado, discretamente
apiculado, côncavo, margens ligeiramente onduladas, (8)9-12(13)
x 6-8 mm, metade inferior esverdeada a marrom claro, ocasionalmente
com pequenas pintas marrons, metade superior marrom escuro. Labelo
3-lobulado, (7)9-11(12) mm compr., quando distendido 10-12(14)
mm entre os ápices dos lobos laterais; base curto-unguiculada,
1 mm compr., amarelada; lobos laterais eretos, paralelos, oblongo-falcados,
(3)4-5(6) x 2-3(4) mm, ápice obtuso, base não constricta,
margens inteiras, lisas, avermelhado a vermelho-arroxeado; calo
verrucoso, ligeiramente sulcado, disposto da base do lobo central
ao pé da coluna, branco, ocasionalmente branco-avermelhado;
istmo separando o lobos laterais do lobo central geralmente proeminente,
algumas vezes alongado, 1-2(3) mm compr.; lobo central variável,
de obcordado a obovado-oblongo a um tanto obreniforme, 5-7 x (5)6-8(10)
mm, ápice com uma dobra proeminente, retuso quando comprimido,
margem lisa, no ápice ocasionalmente verrucoso, amarelo
tornando-se mais claro com o envelhecimento, com margens vermelhas
a vermelho-arroxeado, ocasionalmente com algumas pintas vermelhas
na base. Coluna ereta, discretamente arqueada, trigona, 6-7(8)
mm compr., base amarela, parte mediana branco-avermelhada e em
direção ao ápice verde-arroxeado; pé
da coluna (2.5)3-4 mm compr., base amarela, parte mediana branca
com numerosos pontos vermelhos que confluem em direção
ao ápice. Antera ca. 2-2.5 mm compr., 1.5 mm largura, amarelada,
ápice verde; políneas duas, cerosas, sulcadas, ca.
1 mm compr., 0.5-0.6 mm largura, amarelas; estipe triangular,
hialina, ca. 1 mm compr., 1 mm largura na base. Fruto deflexo,
verde, oblongo a elongado, sulcado, quando novo ca. 6-8.5 x 1-1.5
cm, incluindo o pedicelo.
Etimologia: O nome faz referência à cor marrom-escuro
das sépalas e pétalas.
Espécimes adicionais examinados. BRASIL. Distrito Federal:
Brasília, Vila Maury, 6 Set. 1960 (fl.), Andrade 412 &
Emmerich 404 (HB, R); Brasília, Lago Norte, 8 Out. 1990
(fl.), Batista 122 (CEN), 1 Out. 1991 (fl.), Batista 208 (CEN),
7 Set. 1992 (fl.), Batista 325 (CEN); Guará, Reserva Ecológica
do Guará, 13 Set. 1992 (fl.), Batista 330 (CEN); Brasília,
área entre o Parque Ecológico Norte e o Parque Nacional
de Brasília, 7 Out. 1994 (fl.), Batista 421 (CEN), 11 Dez.
1994 (veg.), Batista 434 (CEN); Brasília, Lago Norte, 17
Feb. 1995 (veg.), Batista 521 (CEN), QL 15, próximo ao
Clube do Congresso, 17 Feb. 1995 (veg.), Batista 523 (CEN); Núcleo
Bandeirante, Santuário Ecológico do Riacho Fundo,
14 Set. 1995 (fl.), Batista & Bianchetti 576 (CEN); Brasília,
área entre o Parque Ecológico Norte e o Parque Nacional
de Brasília, 28 Set. 1998 (fl.), Batista 792 (CEN, HB,
MBM, SP), 30 Dez. 2000 (veg.), Batista 1112 (CEN); Brasília,
área entre o Lago Norte e a EPIA, 6 Jan. 2001 (veg.), Batista
1126 (CEN); Brasília, Lago Sul, condomínio Prive
Morada Sul II, após a QI-28, próximo a barragem
do Paranoá, fl. cult. 22 Set. 2001, Batista et al. 1184
(CEN); Gama, BR-060, próximo ao posto tributário
do GDF e o acesso para Santo Antônio do Descoberto, 2 Out.
2001 (fl.), Batista & Oliveira-Neto 1252 (CEN); Brasília,
Plano Piloto, Asa Norte, 7 Out. 2001 (fl.), Batista 1254 (CEN);
Brasília, Setor de Mansões do Lago Norte, 17 Set.
1990 (fl.), Bianchetti & Batista 953 (CEN), trecho 2, 20 Out.
1991 (fl.), Bianchetti & Batista 1176 (CEN), próximo
a MI-7, 6 Out. 1991 (fl.), Bianchetti & Batista 1168 (CEN);
Guará, Reserva Ecológica do Guará, 26 Ago.
1990 (fl.), Bianchetti & Batista 950 (CEN); Brasília,
Plano Piloto, 10 Nov. 1961 (fl.), Heringer 8756 (HB, UB); Brasília,
Estação Florestal Cabeça de Veado, 8 Out.
1965 (fl.), Heringer 10616 (HB, UB); Santa Maria, 28 Out. 1972
(fl.), Heringer 12206 (HB, UB); ca. 20 km S de Brasília,
na rodovia para Goiânia, próximo ao Rio Melchior,
1125 m, 25 Set. 1965 (fl.), Irwin et al. 8652 (UB); Brasília,
confluência do Rio Torto com o lago Paranoá, 975
m, 9 Out. 1965 (fl.), Irwin et al. 9086 (HB); Guará, Reserva
Ecológica do Guará, 15o50’S-47o57”W,
1050 m, 20 Set. 1994 (fl.), Oliveira 2 (UB). Goiás: Chapada
dos Veadeiros, ca. 26 km N de Alto Paraíso, GO-118, 11
Out. 1999 (fl.), Batista 945 (CEN); ca. 8 km de Niquelândia,
Companhia de Níquel Tocantins, 14o23’48”S-48o25’59”W,
17 Set. 1996 (fl.), Fonseca et al. 1154 (IBGE); Município
de Mineiros, BR-364, próximo ao Córrego Alegre,
20 Set. 1974 (fl.), Hatschbach & Kummrow 35014 (MBM); Goiânia,
30 Nov. 1963 (fl.), Heringer 9289 (HB); Município de Luziânia,
16 Set. 1974 (fl.), Heringer 13971 (HB, UB); 12 km NW de Veadeiros,
na estrada para Cavalcante, 1200 m, 21 Out. 1965 (fl.), Irwin
et al. 9444 (HB, UB); Aparecida de Goiânia/Hidrolândia,
10 Ago. 2002 (fl.), Pastore 32 (CEN). Mato Grosso: 84 km de Alto
Araguaia, em direção à Rondonópolis,
BR-364, Set.-Nov. 1983 (fl.), Hutchison 8550 (UEC). Minas Gerais:
Uberlândia, Estação Ecológica do Panga,
24 Set. 1992 (fl.), Araújo et al. 276 (HUFU); Morro Pelado,
próximo de Campanha, Ago. 1896 (fl.), Brandão in
CGGMG 1719 (R) (misturado com C. cristatum); Município
de Carmo do Rio Claro, Serra da Tormenta, 3 Nov. 1990 (fl.), Campos
s.n. (CEN, HRCB); Serra do Cipó, 23 Ago. 1958 (fl.), Heringer
6438 (HB) (misturado com C. parviflorum); Felixlândia, bacia
de Três Marias, 23 Ago. 1958 (fl.), Heringer 6438 (UB),
2 Out. 1959 (fl.), Heringer 6438 (UB), margens do Rio Paraopeba,
11 Out. 1959 (fl.), Heringer 6438 (UB); Santana do Riacho, km
107 na estrada de Belo Horizonte a Conceição do
Mato Dentro, 4 Out. 1981 (fl.), Pirani et al. in CFSC 7472 (SP,
SPF).
Pabst
foi provavelmente o primeiro orquidólogo a examinar material
do C. brunneum, mas equivocou-se na identificação,
determinando-o primeiro como C. falcilobum Hoehne &
Schltr. (agora considerado um sinônimo do C. parviflorum
Lindl.) e depois como C. poecilum Rchb.f. & Warm. f.
minor Hoehne (agora considerado um sinônimo do C. fowliei
L.C.Menezes). Aparentemente, Pabst também foi o primeiro
taxonomista a suspeitar que o C. brunneum poderia representar
uma espécie nova. Nos seus arquivos pessoais, no Herbário
Bradeanum, há uma ficha com um desenho do C. brunneum
identificado, de um lado, como C. aff. parviflorum
e, no topo, como Cyrtopodium heringeri; mas ele nunca publicou
uma descrição válida da espécie. Mais
recentemente, Menezes descreveu esta espécie como Cyrtopodium
gonzalezii L.C.Menezes (Menezes, 1995), mas inadvertidamente
designou um holótipo que indubitavelmente pertence à
outra espécie já descrita, ou seja, trata-se de
um exemplar de Cyrtopodium brandonianum Barb.Rodr. Essa
situação deixa a nova espécie ainda não
validamente descrita.
O holótipo do C. gonzalezii, localizado na Universidade
de Brasília, é um exemplar único e estéril.
Entretanto, baseado no exame das suas características vegetativas
este exemplar indubitavelmente corresponde ao C. brandonianum.
Primeiro, o holótipo do C. gonzalezii possui pseudobulbos
pequenos, estreitos, enterrados e folhas lineares, eretas, muito
estreitas. Quando comparamos o holótipo com as 25 espécies
de Cyrtopodium conhecidas do bioma, a característica
morfológica dos pseudobulbos (pseudobulbos enterrados)
exclui, para efeito de comparação, várias
espécies que possuem pseudobulbos expostos, como C.
aliciae Linden & Rolfe, C. cardiochilum Lindl.,
C. cipoense L.C.Menezes, C. cristatum Lindl., C.
eugenii Rchb.f., C. hatschbachii Pabst, C. lissochiloides
Hoehne & Schltr., C. palmifrons Rchb.f. & Warm.,
C. paludicolum Hoehne, C. parviflorum Lindl., C.
saintlegerianum Rchb.f., C. virescens Rchb.f. &
Warm., e C. vernum Rchb.f. & Warm.
Segundo, de acordo com o protólogo do C. gonzalezii
(Menezes, 1995) e com a própria Menezes (L.C. Menezes,
com. pessoal), o holótipo foi coletado na “península
do Lago Norte”, um bairro de Brasília onde nós
coletamos intensivamente durante os últimos 12 anos. São
conhecidas seis espécies de Cyrtopodium para o Lago
Norte: C. blanchetii Rchb.f., C. brandonianum Barb.Rodr.,
C. brunneum, C. caiapoense L.C.Menezes, C. poecilum
Rchb.f. & Warm. e C. virescens Rchb.f. & Warm.
Este dado exclui da comparação aquelas espécies
que não ocorrem no Distrito Federal, como o C. braemii
L.C. Menezes e C. dusenii Schltr., ou aqueles que ocorrem
em Brasília, mas não naquela localidade em particular,
como o C. fowliei L.C.Menezes, C. latifolium Bianchetti
& J.A.N.Bat., C. pallidum Rchb.f. & Warm., C.
triste Rchb.f. & Warm. e C. linearifolium J.A.N.Bat.
& Bianchetti. Adicionalmente, os pseudobulbos do C. braemii,
C. fowliei e C. latifolium são externamente
arroxeados, enquanto os do holótipo do C. gonzalezii
são esbranquiçados.
Para efeito de comparação, a caracterização
da parte vegetativa das espécies de Cyrtopodium
de ocorrência no Lago Norte, incluindo o holótipo
do C. gonzalezii, é mostrada na tabela 1. Devido
à similaridade com o C. brunneum, o C. triste
também foi incluído na comparação.
Tabela
I
Características vegetativas de sete espécies
terrestres
de Cyrtopodium conhecidas do Lago Norte, Brasília,
Brasil.
|
|
C.
brunneum |
C.
triste |
C.
brandonianum |
C.
gonzalezii (holótipo) |
C.
poecilum |
C.
banchetii |
C.
caiapoense |
Pseudobulbos
|
Comprimento
(cm) |
(4)5-8.8(7.5) |
(3)4-6 |
3.5-5.5(6.5) |
3.5-4 |
(5)6-8(11.5) |
(4.5)5-8(8.5) |
7.5-8 |
Largura
(cm) |
(1.4)1.7-2.3(2.8) |
1-2.3 |
0.8-1.5(2) |
1.2-1.3 |
1.5-2.8 |
1.5-2.5(3.5) |
0.8-1.2 |
Posição |
enterrados |
enterrados |
enterrados |
enterrados |
enterrados |
enterrados |
enterrados |
Cor |
brancos |
brancos |
brancos |
brancos |
arroxeados |
brancos |
brancos |
Folhas
|
Número |
(4)5-7(8) |
(3)4-5(6) |
(3)4-5(7) |
5 |
(3)5-6 |
(3)4-5(6) |
(6)8-10 |
Comprimento
(cm) |
(6)16-25(33) |
(5)12-21(31) |
|
|
|
|
|
Largura
(cm) |
(0.6)1.1-2.1(2.6) |
(0.8)1.1-1.6(2.0) |
(0.7)1-1.5(2.1) |
0.5-0.9 |
(1.3)2.5-3.5(5.1) |
(1.3)2-2.9(3.4) |
1.2-2.7 |
Razão
compr/largura a |
(8.1)9.5-15.5(17.2) |
12.9-15.5(21.9) |
(31.2)37-42(60) |
55 |
(12.7)16.5-18.5(30) |
(11.6)18.5-25(33.2) |
15.3-18.5(21.6) |
Razão
compr/largura b |
(6.7)8.5-16.7(22) |
(7.2)10-21(29.3) |
(15)30-58(76) |
55 |
(7.6)11.3-20.8(30.6) |
(8.8)14-30(47.2) |
10-22(31.7) |
Forma |
lanceoladas |
linear-lanceoladas |
lineares |
lineares |
lanceoladas |
lanceoladas |
lanceoladas |
Posição |
patentes |
patentes |
eretas |
eretas |
patentes |
eretas |
eretas |
Articulação |
presente |
presente |
presente |
presente |
presente |
presente |
presente |
Comprimento
(cm) |
(0.5)1-2(3) |
(0.5)1-2(2.5) |
(2.5)4-6(10.5) |
4-4.5 |
(2.5)3.5-6.5(8) |
(3)4.5-6.5(8) |
2-3.5(6) |
|
a
- média por planta
b - média por folha |
|
Todas as medidas foram realizadas a partir de exemplares vivos
em condições de campo, exceto para os pseudobulbos
dos espécimes herborizados e o holótipo do C. gonzalezii,
que foram obtidas de exemplares secos. Para se obter uma comparação
mais precisa, na análise foram considerados apenas indivíduos
adultos e apenas folhas maduras, completamente desenvolvidas.
O comprimento das folhas foi medido a partir da superfície
do solo, correspondendo aproximadamente do ápice dos pseudobulbos
ao ápice das folhas.

Fig.
7. Cyrtopodium poecilum. Folhas completamente desenvolvidas.
Planta em vegetação natural de campo sujo |
Cyrtopodium
poecilum (Fig. 7) e C. blanchetii (Fig. 8) possuem
folhas muito mais largas do que o C. gonzalezii. |

Fig.
8. Cyrtopodium blanchetii. Planta com folhas completamente
desenvolvida e frutos. |

Fig. 9. Cyrtopodium poecilum.
Pseudobulbos. |

Fig. 10. Cyrtopodium blanchetii.
Pseudobulbos. |

Fig. 11. Cyrtopodium caiapoense.
Parte vegetativa. |
Os pseudobulbos do C. poecilum são externamente
arroxeados (Fig. 9) e, portanto, distintos de todas as demais
espécies comparadas; os pseudobulbos do C. blanchetii
são maiores (Fig. 10) que os do C. gonzalezii.
Cyrtopodium caiapoense possui folhas em maior número
(Fig. 11), e os pseudobulbos geralmente mais compridos que C.
gonzalezii, enquanto que C. brunneum e C. triste
possuem folhas mais curtas e geralmente mais largas. Ou seja,
a parte vegetativa de nenhuma das cinco espécies anteriores
é compatível com o holótipo do C. gonzalezii
(Tabela 1).
Comparando especificamente C. brunneum e C. gonzalezii,
o valor médio da razão entre o comprimento e a largura
das folhas foi de 9.5-15.5 para o C. brunneum, e 55 para
o C. gonzalezii (Tabela 1). Adicionalmente, as folhas do
C. brunneum são tipicamente patentes (Figs. 4-5),
enquanto que no C. gonzalezii são eretas.
Os
pseudobulbos do C. brunneum são geralmente um pouco
maiores do que os do C. gonzalezii. Outra diferença é
a posição da articulação das folhas
em relação ao ápice dos pseudobulbos (correspondente
à superfície do solo para as espécies de
pseudobulbos enterrados), que é bem mais curta no C.
brunneum do que no C. gonzalezii.
 Fig.
12. Cyrtopodium brandonianum. Planta com folha desenvolvidas.
Fig.
12. Cyrtopodium brandonianum. Planta com folha desenvolvidas. |
Das
espécies apresentadas na tabela 1, a única
que apresenta características compatíveis
com o holótipo do C. gonzalezii é o
C. brandonianum (Figs. 12-13). |
 Fig.
13. Cyrtopodium brandonianum. Pseudobulbos.
Fig.
13. Cyrtopodium brandonianum. Pseudobulbos. |
Para analisar essa semelhança com maiores detalhes, uma
plotagem do comprimento x largura das folhas de exemplares do
C. brunneum, do holótipo do C. gonzalezii e
de C. brandonianum é apresentada na figura 14. Estes resultados
mostram que as características vegetativas do holótipo
do C. gonzalezii são distintas dos C. brunneum,
C. triste, C. poecilum, C. blanchetii e C.
caiapoense, mas caem dentro da faixa de variabilidade do C.
brandonianum.
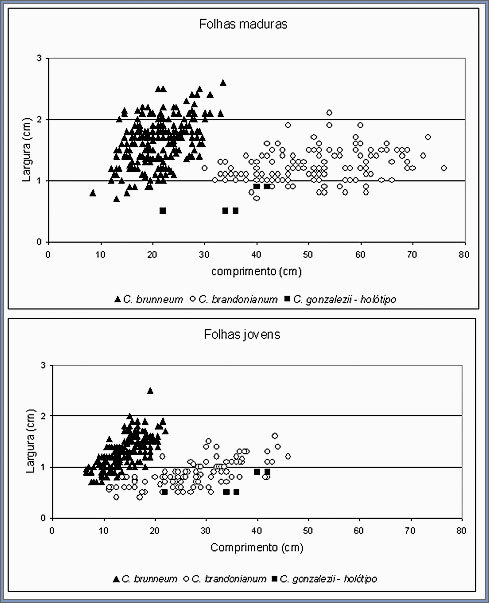
Fig.
14. Gráfico do comprimento x largura de folhas
maduras e folhas jovens (incompletamente desenvolvidas)
do C. brunneum, C. brandonianum e o holótipo
do C. gonzalezii. As medidas do holótipo
do C. gonzalezii são as mesmas tanto para
as folhas maduras como para as folhas jovens. |
Quanto comparado ao C. brandonianum, os valores um pouco
mais baixos para o C. gonzalezii, particularmente em relação
à largura das folhas, pode ser explicado pelo fato das
medidas terem sido realizadas a partir de um exemplar seco, onde
as folhas podem ter encolhido durante o processo de secagem. Essa
secagem e encolhimento dificultam a expansão completa das
folhas durante a análise. O número e tamanho dos
pseudobulbos indicam que o material tipo do C. gonzalezii é
quase certamente um individuo adulto, mas com folhas imaturas.
Para examinar em maior detalhes esta possibilidade, o comprimento
e largura de folhas imaturas do C. brunneum e C. brandonianum
foram plotados junto com os dados do holótipo do C.
gonzalezii (Fig. 14). Novamente, e com uma coincidência
ainda maior, as medidas das folhas do holótipo do C.
gonzalezii caem na faixa do C. brandonianum. Em concordância
com estes resultados, a data de coleta do material tipo do C.
gonzalezii é indicada, na etiqueta do holótipo,
para o início de novembro. Comparado com a maioria das
espécies de Cyrtopodium no Brasil central, que florescem
no final da estação seca e no começo da estação
chuvosa (setembro a novembro), C. brandonianum floresce principalmente
durante o auge das chuvas (dezembro e janeiro). Entretanto, em
comum com a maioria das espécies, o desenvolvimento vegetativo
do C. brandonianum começa no início da estação
chuvosa, geralmente em outubro, de modo que em novembro (data
de coleta do holótipo do C. gonzalezii) as plantas
já iniciaram o crescimento vegetativo, mas têm folhas
não completamente desenvolvidas.
Ainda, para efeito de comparação, das espécies
restantes que apresentam características de comportamento
terrestre e pseudobulbos enterrados, apenas duas possuem folhas
lineares, longas e estreitas, como o holótipo do C.
gonzalezii. A primeira, C. linearifolium, ocorre em
solo escuro, areno-argiloso, associado à vegetação
de campo rupestre encontrada em altitudes maiores, possui folhas
não articuladas e, no Distrito Federal é conhecida
apenas dos campos limpos de altitude da Chapada da Contagem. A
segunda, C. pallidum, é conhecida de várias
localidades do Distrito Federal, mas é típica de
solos escuros, areno-argilosos encontrados em locais mais úmidos
(próximo de matas de galeria), geralmente associados com
pequenos montes de terra conhecidos como murundus, e não
ocorre em latossolo vermelho escuro encontrado no ‘Lago
Norte’.
Em suma, nós concluímos que o exemplar tipo C.
gonzalezii representa um indivíduo do C. brandonianum
com folhas não completamente desenvolvidas.
Uma análise crítica da descrição do
C. gonzalezii (Menezes, 1995) revelou uma mistura de características,
com a parte vegetativa correspondendo ao C. brandonianum
e as partes reprodutivas ao C. brunneum. Menezes (1995)
tinha a intenção de descrever uma espécie
nova e, de fato, as figuras das flores na descrição
original são do C. brunneum. Todavia, de acordo
com o Código Internacional de Nomenclatura Botânica
(Greuter et al., 2000), o tipo nomenclatural (typus) é
o elemento ao qual o nome de um táxon está permanentemente
atrelado, seja como um nome correto ou um sinônimo. Uma
vez que, como indicado acima, o holótipo do C. gonzalezii
corresponde ao C. brandonianum, nós propomos a sinonimização
do C. gonzalezii sob C. brandonianum, apresentada
abaixo no final dos comentários sobre a espécie.
Cyrtopodium brunneum é encontrado preferencialmente
em vegetação de campo limpo e campo sujo (Fig. 2),
em solo argiloso, profundo, avermelhado (latossolo vermelho-escuro),
sob pleno sol, protegido apenas pela vegetação herbácea
circundante. Este tipo de solo pode apresentar-se superficialmente
úmido por períodos breves, durante as chuvas, porém
não possui a capacidade de reter água por períodos
longos e seca completamente durante a estação seca.
Cyrtopodium poecilum Rchb.f. & Warm., C. brandonianum
Barb.Rodr., C. triste Rchb.f. & Warm., C. blanchetii
Rchb.f. e C. caiapoense L.C.Menezes ocorrem no mesmo
habitat e são freqüentemente encontrados juntos com
C. brunneum.

Fig. 2 - Cyrtopodium brunneum.
Habitat durante a floração. Cerrado queimado
na localidade de coleta do material tipo, cerca de 2 semanas
após o fogo, com a vegetação começando
a brotar no começo de setembro. |
Menos freqüentemente, C. brunneum é também
encontrado em solo raso, arenoso-argiloso, pedregoso, onde cresce
próximo aos C. vernum Rchb.f. & Warm e C.
cristatum Lindl. Ocasionalmente, a espécie ocorre em
cerrado mais fechado, sob sombra parcial. Em todos estes habitats,
os pseudobulbos do C. brunneum encontram-se completamente
enterrados no solo, mas algumas vezes o ápice pode se apresentar
exposto.
A floração do C. brunneum se estende do final
da estação seca ao começo da estação
chuvosa, do final de agosto a novembro, mas concentra-se entre
setembro a outubro. Essa floração coincide com as
florações dos C. poecilum, C. blanchetii,
C. caiapoense, C. cristatum e C. vernum, enquanto
que as florações de C. triste (final de outubro
ao começo de dezembro) e de C. brandonianum (principalmente
de dezembro a janeiro) são mais tardias.

Fig.
3. Cyrtopodium brunneum. Inflorescência. Note as folhas
pouco desenvolvidas durante a floração. |
De
maneira similar a outras espécies terrestres de
Cyrtopodium, a floração é
estimulada por fogo e, entre as espécies com pseudobulbos
pequenos e enterrados, C. brunneum é geralmente
o primeiro a florescer após uma queimada. A inflorescência
aparece alguns dias após o fogo e as plantas estão
em plena floração 2-3 semanas depois (Fig.
3).
A observação de plantas floridas da espécie
em locais não queimados é provavelmente
muito rara e pouco freqüente; nunca observamos plantas
florescendo em áreas não queimadas. Plantas
cultivadas podem florescer sem fogo, mas com uma freqüência
muito baixa e somente quando submetidas a stress hídrico.
As flores possuem um odor adocicado e discreto.
A formação de frutos é baixa sob
condições naturais, mas a remoção
do polinário é um tanto freqüente,
indicando que a deposição no estigma pode
ser um fator limitante, ao invés da ausência
de polinizadores.
A espécie mais próxima do C. brunneum
é, aparentemente, o C. triste. No aspecto
vegetativo, C. brunneum e C. triste são
muito parecidos e de difícil discriminação
(difíceis de separar). |
As principais
diferenças vegetativas entre as duas espécies são
apresentadas na tabela 1. Adicionalmente, espécimes de
C. brunneum apresentam folhas geralmente mais delgadas,
flexíveis e menos coriáceas (raramente quebram quando
dobradas); parte basal lateralmente comprimida (conduplicadas);
geralmente tornam-se verde claro e depois amarelas antes de caírem
e tendem a cair mais cedo do que as folhas C. triste. Por
outro lado, espécimes de C. triste apresentam folhas,
geralmente, ligeiramente mais rígidas e coriáceas,
de tal modo que geralmente quebram-se quando dobradas; parte basal
mais plana do que no C. brunneum; e mudam pouco de cor durante
o envelhecimento, passando de verde para marrom-palha.
O
desenvolvimento das folhas do C. brunneum é
também dependente de condições ambientais.
Plantas crescendo à sombra, em cerrado típico,
em solo argiloso e profundo, geralmente apresentam o desenvolvimento
máximo das folhas, tanto em comprimento quanto
em largura. Plantas crescendo em encostas rochosas, em
pleno sol, em solo arenoso, raso e pobre em nutrientes,
são bem menores e semelhantes ao C. triste
quanto ao comprimento das folhas, mas não em largura
(exemplares pouco desenvolvidos de C. triste possuem folhas
muito estreitas). O desenvolvimento das folhas durante
a antese é incipiente e tornam-se maduras apenas
1-2 meses após a floração.
Como quase todas as espécies de Cyrtopodium
do Brasil central, C. brunneum cresce durante o
período chuvoso e torna-se dormente durante a estação
seca, quando perde as folhas. As plantas comumente aparecem
em grupos, com exemplares (de três a mais de 15)
crescendo próximos um do outro
(Fig. 15).
Cyrtopodium brunneum e C. triste também
são parecidos em termos de coloração
das flores. Ambas as espécies possuem sépalas
e pétalas marrom escuro e o labelo amarelo-avermelhado.
|
|

Fig.
15. Cyrtopodium brunneum. Grupo de plantas, pouco após
a floração com os frutos em desenvolvimento
inicial. |

Fig.
16 - C. triste. Flor. |
Todavia,
C. triste freqüentemente apresenta a inflorescência
ramificada com até três ramificações
laterais, flores maiores e o labelo com os lobos laterais
largamente obovados (Fig. 16).
No aspecto geral, C. brunneum também é
similar ao C. dusenii Schltr. Entretanto, as folhas
do C. dusenii são bem desenvolvidas durante
a antese, a inflorescência é geralmente ramificada,
com (0)1-2(3) ramificações laterais e as
flores menores e completamente amarelas com pintas marrons.
Cyrtopodium brunneum também tem sido confundido
com o C. parviflorum, que apresenta flores com
a coloração parecida e os lobos laterais
do labelo falcados (Fig. 17). |

Fig.
17 - C. parviflorum. Flor. |
Todavia, C.
parviflorum possui pseudobulbos maiores e expostos (7-20 cm
de comprimento), folhas não articuladas, inflorescência
mais alta e freqüentemente ramificada, (0.6-1.2 m de altura
e (0)2-4 ramificações laterais), flores ligeiramente
maiores e os lobos laterais do labelo mais longos (8-10 mm de
comprimento). Adicionalmente, C. parviflorum ocorre em
locais úmidos e quando encontrado em locais mais secos,
geralmente são solos arenosos sob vegetação
de campo rupestre, não sendo nunca encontrado em latossolo
vermelho-argiloso em vegetação de cerrado típico.
|
A
cor das flores do C. brunneum é relativamente
constante (Figs. 6a-b), especialmente
quando comparado com outras espécies como C.
braemii L.C.Menezes e C. pallidum Rchb.f. &
Warm., que são altamente variáveis no padrão
de coloração. Todavia, C. brunneum
é extremamente variável quanto à
morfologia do labelo (Fig. 1, E. a-e), particularmente
do lobo mediano e, provavelmente, trata-se de uma das
espécies mais variáveis no gênero
para esta característica.
Até onde foi possível averiguar, C. brunneum
foi coletado pela primeira vez durante os trabalhos
da Comissão Geológica e Geográfica
de Minas Gerais, em Campanha, no sul do estado, em 1896
e posteriormente por Ezechias Heringer em 1958.
Cyrtopodium brunneum não é uma espécie
incomum;entretanto, os pseudobulbos enterrados |
 Fig.
6a - C. brunneum. Flor Fig.
6a - C. brunneum. Flor |
 Fig.
6b - -C. brunneum. Flor Fig.
6b - -C. brunneum. Flor |
e plantas pequenas crescendo encobertas pela cobertura graminosa,
tornam a localização dos indivíduos, no campo,
uma tarefa difícil. As plantas são mais facilmente
localizadas quando em floração em áreas anteriormente
queimadas. A distribuição conhecida da espécie
inclui os estados de Goiás, Mato Grosso, Minas Gerais e
o Distrito Federal, que compreendem as porções central,
centro-oeste e sudeste do Cerrado brasileiro. Baseado nessa distribuição
é esperado que a espécie também ocorra na
região de cerrado do Tocantins e oeste da Bahia.
Cyrtopodium
brandonianum Barb.Rodr., Gen. Sp. Orchid. 1: 132. 1877. Typus:
BRASIL. Minas Geraes, Capivary, Barbosa Rodrigues s.n. (Nenhum
material original é conhecido. Tipificado por Cribb &
Toscano de Brito, 1996: 1: 30. Ilustração original
de Barbosa Rodrigues reproduzida por Sprunger, 1996: 1: 332).
Cyrtopodium
gonzalezii L.C.Menezes in Boletim CAOB 6(1): 9. 1995. Typus:
BRASIL. Distrito Federal, península do Lago Norte, 9 Nov.
1994, L. C. Menezes UB-54 (HOLOTYPUS: UB).
| continua |
 |
Expressamente
proibido qualquer tipo de uso, de qualquer material
deste site (texto, fotos, imagens, lay-out e outros),
sem a expressa autorização de seus autores,
sob pena de ação judicial. Qualquer solicitação
ou informação pelo e-mail bo@sergioaraujo.com |
|